研究する理学学生の第3弾として、化学専攻 修士課程1回生の武島愛夏さんの研究をご紹介します。
「触媒の『応答』を見て、その性質を調べるようなところがすごくおもしろくて研究しています」という武島さんに、設計開発する有機分子触媒、アミン触媒の研究と研究生活について語っていただきました。

高校化学の授業をきっかけに
*1
近代工業では、窒素と水素からアンモニアを生産するハーバー・ボッシュ法で触媒(金属触媒)が使われていることが知られている。知らないことを学ぶのは好きだったので大学には進学したいと思っていたものの、どの学部に行くかを迷っていました。ただ、高校の化学の授業で習ったハーバー・ボッシュ法(アンモニア合成法)1の、ほんのちょっとの量で働く触媒(化学反応を促進し、それ自体は反応の前後で変化しない物質)の作用がすごく不思議で、とても印象的でした。
それがきっかけで、漠然と触媒に関係する分野を勉強しようと考えていましたが、初めから化学分野に進むと決めてしまうのもどうかなという思いもあり、分野を決めかねていたんです。
そんな時、京都大学理学部が緩やかな専門化という、入学時から専攻や学科が決まっていない理学部一学科で、1、2回生から学年が上がるにつれてだんだん専門的になり3回生に進級するときに専攻が決まるカリキュラムだということを知りました。 こうして、色々勉強していく中で専攻分野を決められる本学理学部に入学しました。
本学理学部では、4回生から研究室所属になります。納得するまで研究したいと考えていたので、大学院に進学することは入学時から決めていました。
光学活性をもつアミン触媒
*2
有機触媒(organocatalyst)は、有機分子触媒とも呼ばれ、金属元素を含まず、炭素・水素・酸素・窒素・硫黄等の元素から成り、触媒作用をもつ低分子有機化合物のことを指す。
もともと触媒は、生体分子(酵素)と金属が主であったが、1970年代初頭に、初めてタンパク質を構成する天然のアミノ酸が触媒として作用するという報告があった。2000年のはじめには、ListとBarbasらがアルドール反応によって、プロリン(アミノ酸の一種)が触媒として働くことを示した。これを契機に、プロリンから誘導された数多くの有機触媒が創製された。続いて同年に、David MacMillanがアミン触媒によって従来の金属触媒を使う必要がないことを示し、「有機触媒(Organocatalyst)」という言葉を提唱した。
有機触媒の特徴は、次のとおり。(丸岡啓二編:進化を続ける有機触媒 有機合成を革新する第三の触媒, 化学同人(2009), p.16 )
- 空気や水が存在していても反応を行うことが可能で、実験技術的な面からも大きなメリットがある。
- 従来の金属含有触媒にくらべて触媒が比較的安価であり、廃棄物の毒性が低いなど環境負荷の小さいものが多く、グリーンケミストリーの観点から有用である。
- 生体触媒(酵素)や金属触媒よりも化学的安定性の点で勝る。
- 触媒の回収、再利用を簡便に行うことができる。
- それぞれの有機触媒反応は比較的鈍感なため、連続反応が可能になる。
- 現在、世界的に問題となっているレアメタルの不足、高騰を解決するための元素戦略技術として利用できる。
*3
有機分子は基本骨格(炭素と炭素がつながった炭素の鎖)とそれに付随した置換基からなっている。置換基のうち、メチル基CH3やエチル基CH2CH3のような炭素、水素が単結合で結合したものをアルキル基といい、記号Rで表す。アルキル基以外の置換基が官能基であり、多くはC、H以外の元素を含んでいる。官能基は分子の性質を決める重要な要素。*4
有機分子は基本骨格(炭素と炭素がつながった炭素の鎖)とそれに付随した置換基からなっている。置換基のうち、メチル基CH3やエチル基CH2CH3のような炭素、水素が単結合で結合したアルキル基Rが窒素Nに2個ついたものを二級アミンという。研究では、光学活性をもつ新しい有機触媒2のアミン触媒(amine catalysis)をつくっています。
アミンとは、代表的な官能基(functional group)3であるアミノ基(-NR2)をもつ分子のことです。
まず、光学活性の話をします。左手型と右手型で鏡写しの関係というのが鏡像異性体(エンチオマー enantiomer, 光学異性体)で、そういう性質をもつものを光学活性があるといいます。動物や植物の内部で働く有機化合物、グルタミン酸のうま味や自然界にあるアミノ酸等は光学活性なものが多く、左手型(L体)と右手型(D体)の性質をもっています。
たとえば、よくデザートに添えられる緑葉のミントの中に含まれるメントールを例に挙げると、自然界ではミントのさわやかな香りの分子(左手型)ができますが、メントールを実験室でつくると、消毒薬のような匂いがする分子(右手型)もつくることができます。
物理的性質もそっくりですが、光学活性がある有機化合物は左手型と右手型で性質が違います。その鏡像異性体のどちらか一方の性質をもつ生成物をつくることが可能になれば、大変有用です。そうした光学活性の物質の左手型と右手型のどちらかを選択的に合成する、「選択性を出す」方法を不斉合成といいます。
アミン触媒は、有機分子触媒化学における代表的な触媒として汎用されており、エナミン中間体を経て反応を促進します。その反応機構は、図1のような一般式で表すことができます。
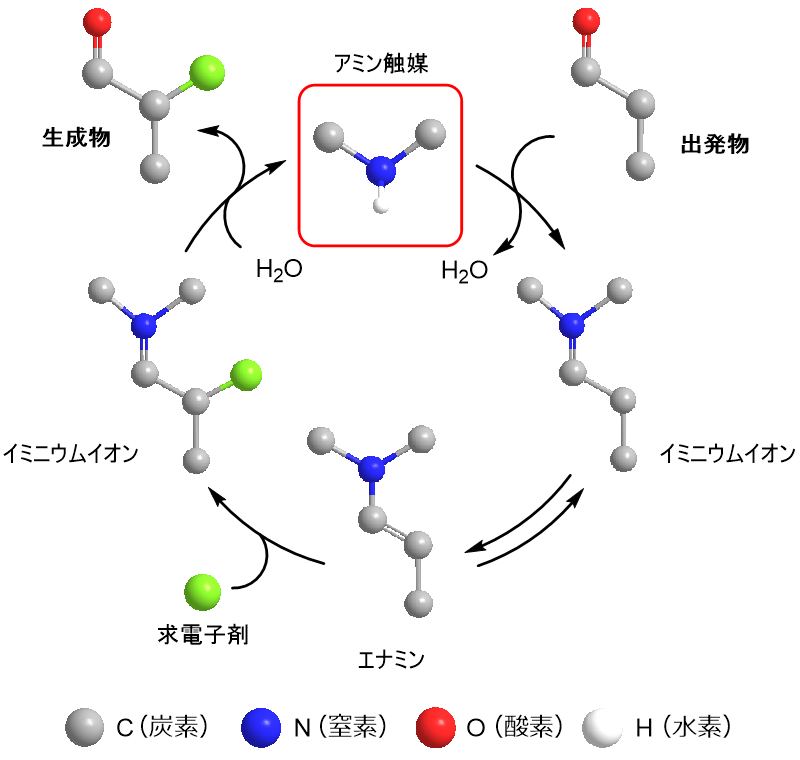
図1 二級アミン触媒の基本的な反応機構 (作成:武島愛夏)
まず二級アミン触媒4とアルデヒドとの脱水縮合によって形成されるイミニウムイオン中間体がエナミンへ異性化(変化)する。このエナミンが求電子剤と反応し、再びイミニウムイオンが生成する。そして加水分解を経て生成物を与えるとともにアミン触媒が再生する。
このような二級アミン触媒により数多くの不斉反応(光学活性をもつ物質の左手型と右手型のどちらか一方を合成すること)が達成されてきました。 その先駆けとなったのは、天然に存在するアミノ酸、プロリン(proline)による不斉反応です。
*5
左手型と右手型のような鏡像関係で重ねられない性質をキラリティーchiralityといい、そのような性質をもつ物体をキラルchiralであるという。光学活性をもたない出発物をキラル触媒を用いて反応させると、光学活性をもつキラルな生成物が得られる。中でも、私の所属する研究室で開発した剛直なビナフチル構造を有するキラル5二級アミン触媒(S)-1(2005年に論文で発表)は、不斉場(光学活性をもつ物質の左手型と右手型のどちらか一方を合成する場)をつくるうえで非常に優秀です。この触媒(S)-1は、プロリンではいき過ぎてしまう反応を制御することができます。
これまでのアミン触媒の問題点
しかし、既存の触媒(S)-1の合成には、原料のジカルボン酸が入手困難であり、取り扱いが難しい試薬を大量に用いることから合成のスケールアップができないといった問題点がありました。 また、ビナフチル基の骨格構造によって七員環(6個の炭素原子と1個の窒素原子からできた環)が固定されるので、不斉触媒の基本構造として非常に優れていますが、触媒構造が画一的になりやすく、触媒設計における構造的な多様性を損なう原因にもなっていました。
そのような問題点を解決するため、入手容易な原料から簡便に合成でき、かつビナフチル基のような大きな骨格構造から脱却した、新しい二級アミン触媒の骨格構造を編み出すことを私の研究テーマとしました。
光学活性をもつ新しいアミン触媒の骨格を編み出す
*6
分子の組み立てモデリング、可視化アプリケーションのPCソフト。新しいアミン触媒の骨格を設計するため、はじめに模型を組んだり、Chem3D6でどのような構造が適切なのかを予測しました。
そもそも、既存の触媒(S)-1を用いたときの反応において選択性を出す(光学活性の物質の左手型と右手型のどちらかを選択的に合成する)のに重要なのは、酸性官能基とアミン部位の2つの窒素Nの相対的な位置関係でした。 そのために、七員環の構造がある程度剛直に固定されていることが必要です。 既存の触媒(S)-1では、ビナフチル基の二重結合性によって七員環の配座が固定されていました。
*7
6個の炭素原子からなる正六角形の分子で大きな安定性をもつ有機化学において重要な化合物。それで、新しい骨格のアミン触媒(S,R)-2では、ビナフチル基の一方をベンゼン環7、もう一方を三角のシクロプロパン環(3個の炭素原子からなる環)に置き換えています(図2-1)。 シクロプロパン環は、農薬や医薬の分野において二重結合の等価体として使われる骨格なので、既存の触媒(S)-1の構造にある七員環を固定する二重結合(部位)の代わりができるのではないかというコンセプトで設計しました。
実際に模型を組んでみたりChem3Dで構造の最適化を行い、窒素N間の距離や位置関係を調べてみたところ、新しい触媒(S,R)-2も既存の触媒(S)-1と同様な不斉場をつくることができそうだとわかり、実際に合成してみてそれを確かめることにしました。
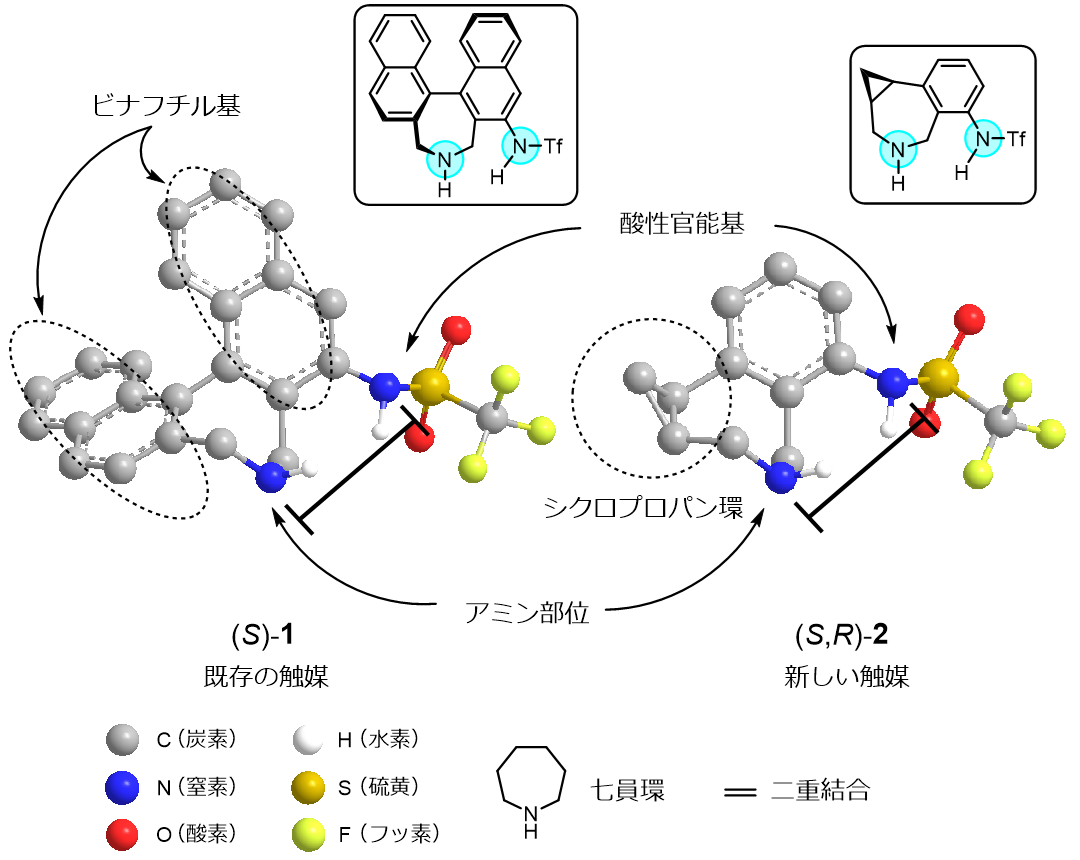
図2-1 触媒のデザインの妥当性を示す図 (作成:武島愛夏)
反応において重要なアミン部位(窒素N)と酸性官能基(窒素N)の位置関係が、触媒が安定構造をとったときに新しい触媒(S,R)-2、既存の触媒(S)-1で同様であることを示している。
試行錯誤を重ね、最終的には図2-2のような合成の工程で新しい骨格のアミン触媒(R,S)-2をつくりました。中間体を合成する過程で、反応を促進するL体(左手型)のアミノ酸を触媒として用いたため、設計時の(S,R)-2とは鏡像異性体の関係にある(R,S)-2が得られました。
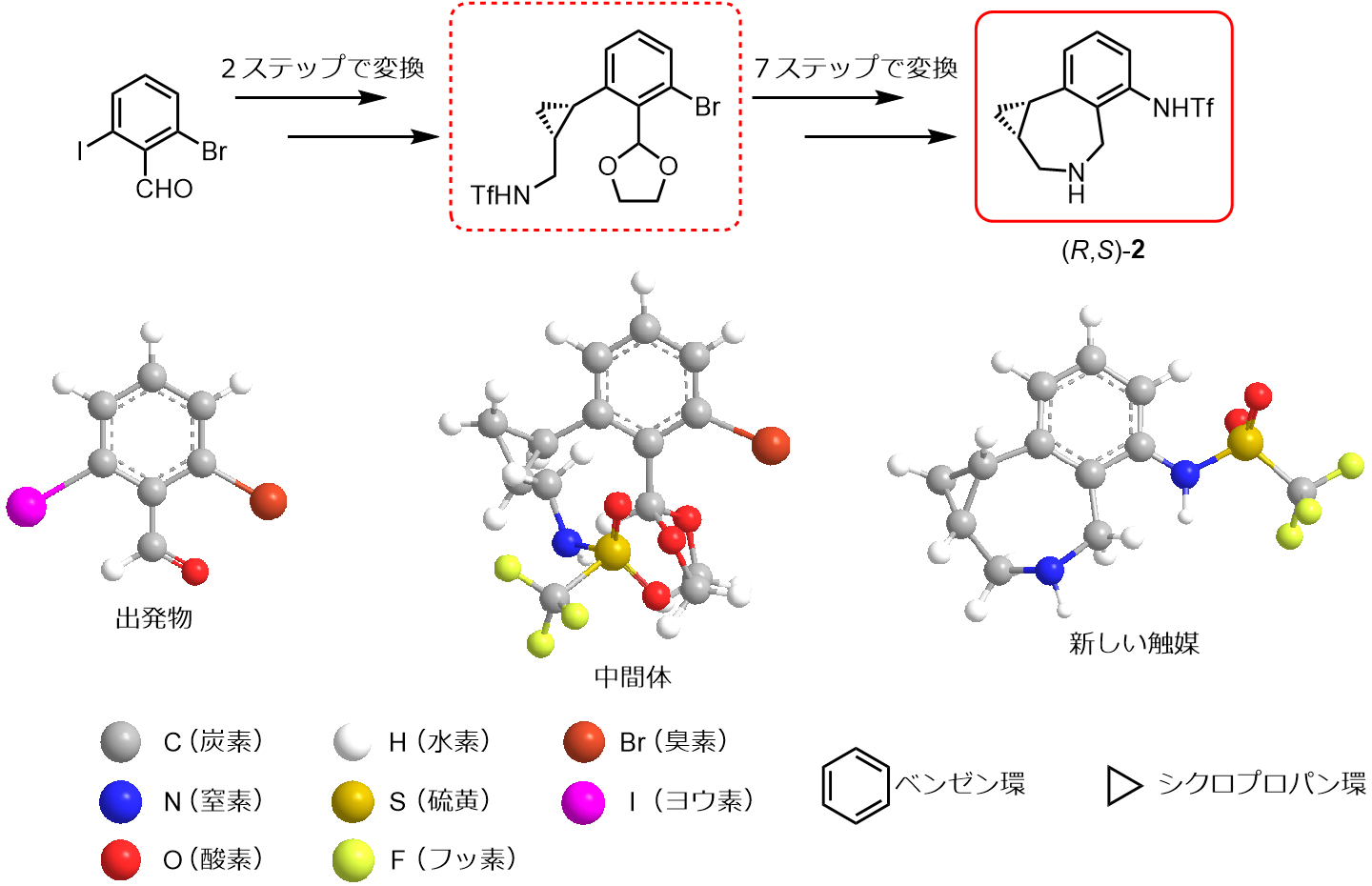
図2-2 新しいアミン触媒(R,S)-2を合成する工程 (作成:武島愛夏)
出発物の2-ブロモ‐6-ヨードベンズアルデヒド(2-bromo-6-iodobenzaldehyde)から反応工程2ステップで中間体を合成、中間体から7ステップで新しい触媒へ変換。
この新しいアミン触媒(R,S)-2を実際に実験で使ったところ、設計時の期待通り、既存の触媒(S)-1と同様な不斉場がつくられるという結果が得られました。
新しいアミン触媒の特徴
*8
金属触媒では、医薬品をつくるうえで残存する金属が有害になると懸念されるが、金属触媒を使用せず有機分子触媒を使うことで危険性はなくなる。新しいアミン触媒(R,S)-2は、安価で入手容易な原料から簡便に合成でき、また危険な原料を利用せずに合成でき、メタルフリー8な反応を実現できます。 しかも、フェニルシクロプロパン構造に由来する光学活性をもつので、その新しい触媒(R,S)-2を使うと、左手型か右手型の性質をもった生成物を選択して得ることができます。
さらに、骨格の構造が既存触媒(S)-1の大きな骨格(ビナフチル構造)に比べてコンパクトなことにより、反応性が変わります。また、構造にバリエーションを出すことができるので触媒の骨格設計に多様性をもたせることができます。
現在、この新しい骨格の触媒(R,S)-2が、実際の反応においてどのような性質をもっているのかを調べています。 新しい骨格の触媒(R,S)-2の不斉場について、既存の触媒(S)-1のビナフチル基の骨格と同様な不斉場がつくられているということはがわかっていますが、次の2つの性質について探索中です。
ひとつは、活性(化学反応を促進しやすいこと)についてです。 新しい触媒(R,S)-2は、既存の触媒(S)-1と微妙に活性がちがうということや、骨格の違いに起因する性質の違いがわかってきました。 もしかすると、この新しい触媒(R,S)-2をもってすれば、既存の触媒(S)-1でうまくいかなかった反応を解決するかもしれないという期待をもっています。
*9
動植物や微生物などから得られる複雑な分子構造をもつ目的の天然物を、人工的に合成すること。
実験中(カラム中)。
これまでの触媒ではできなかった反応ができるようになれば、これまで合成が難しかった化合物を簡単に作ることができます。あるいは、その変換された生成物を中間体として短工程で効率的に天然物を全合成9できるかもしれません。
もうひとつは、この新しい触媒(R,S)-2の骨格構造が既存触媒(S)-1のビナフチル基と比べてコンパクトなことによる反応性の違いについてです。
シクロプロパン環は、大きさや酸性度の点で他の炭化水素鎖とは異なる性質を持ちます。そんなシクロプロパン環を持つことによって、単にコンパクトさだけではなく既存の触媒(S)-1にはなかった反応性を示すのではないかと仮定し、この特性を生かした新たな反応開発を目指しています。
触媒の「応答」と達成感
触媒を研究していて面白いのは、「あなたはどういう性質をもっているんですか?」と、触媒の「声」に耳を傾けながら行えるというところです。 これとこれを反応させるためには、この触媒はどれくらい有効に働いてくれるのかということについて、マクロな実験の結果から、ミクロな触媒の性質を見ています。
このように、触媒の「応答」を見て性質を調べるようなところにおもしろさを感じています。
実は、はじめに想定した触媒を合成する工程では、七員環構造を構築する段階で狙っていた反応が起こらず困っていました。そこで、反応しやすい官能基(アミン-NR2とアルデヒドRCHO)を先にベンゼン環上に導入すれば七員環構造をつくりやすいのではないかと考え、合成する工程を変更したところ、うまくいきました。
その後、様々な反応を組み合わせて最終的に新しい触媒(R,S)-2をつくることができました。
試行錯誤を経て実際に新しい触媒(R,S)-2を合成できたとき、また合成した新しい触媒(R,S)-2が不斉反応で高い選択性を示したときの達成感は非常に大事な経験でした。
自主ゼミ、そしてダンスサークル
理学部2回生のときには、化学系志望の同級生と有機化学の勉強をするため自主ゼミを行っていました。頭をかかえながらも予習したり、授業で担当の先生に積極的に質問しに行きました。
また、学内で興味を持つサークルがなかったので調べていたところ、関西で同じ趣味をもつ社会人を見つけました。それで、3回生の前期から、社会人と学生何人かで学外にサークルを立ち上げることになったんです。 メンバーを集めたり、活動場所を探したり、練習をしたりして活発に活動をしていました。
それは、特に好きなグループのダンスをコピーして踊るダンスサークルです。 衣装を揃えて、イベントの場に出演したり、ダンスの動画をウェブサイトにアップして披露していました。
4回生からは研究室に入って忙しくなったので、そのサークルにはあまり参加できなくなったんですけど、楽しい思い出です。
餃子部
日夜研究に取り組んでいるとはいえ、おもしろさや癒しを忘れてはいません。 所属する有機合成化学の研究室には、餃子を大食する「餃子部」があるんです。
去年、研究員として初めて給料を頂いた先輩が、「餃子部やろう!」と京大近くの店で焼き餃子を20人前以上購入し、研究室のメンバーでひたすら食べました。 今年は、先輩が「焼き方を練習してきたから」ということで、研究室で生餃子をたくさん焼いてふるまってくれました。 和気あいあいとしながら、研究室の仲間と親睦を深めています。


ビーカーカップを使う指導教官の加納太一先生。
また、化学の研究室ならではのアイテムでおもしろいなと思ったのは取手のついたビーカーカップです。入れた飲み物の量がわかりやすく、研究室内で何人かに愛用されています。
将来
将来は、博士課程への進学を志望しています。有機合成化学における学びと研究を深め、「私はこの分野のエキスパートです」と胸を張って言えるようになりたいです。
身につけてきた専門性を活かし、ゆくゆくは製薬会社等で、世界中に影響を与えるような、多くの人を助けられるような化合物を創るために、なにかしら私の研究開発が役立つことを望んでいます。
面白いことは向こうからやってこない

開発した新しい触媒(R,S)-2と分子模型。
京大は面白い大学だとよく取り上げられますが、ボーっと待っていても面白いことは向こうからはやってこないので、自分から興味のある分野やコミュニティに能動的にかかわっていくことが大事です。
また、将来何をすればよいかを迷っている、あるいは、いろんなことをやりたいけれどまだ絞れていない学生にとっては、京大は良い環境が備わっています。いろんな分野を見て触れて、感じて、学んでいくことができます。
特に理学部では、3回生で専攻を決めるまでの1、2回生のときに、自分が興味のあることはなんでも学べる特徴があります。加えて、博識で面白い同級生や先輩、後輩が多く、視野を広げられるところも魅力だと思っています。
現在、化学のすごさを目の当たりにしながら研究しています。 そんな刺激的な研究の場で、自分で考えたことを世の中に初めて創り出すことができ、将来携わりたいと思う研究に少しでも近づくことができるような環境を提供頂いている先生と先輩方に感謝しています。
参考文献
日本化学会編:有機分子触媒の化学 モノづくりのパラダイムシフト, 化学同人(2016)
丸岡啓二編:進化を続ける有機触媒 有機合成を革新する第三の触媒, 化学同人(2009)
齊藤勝裕・奥山恵美:わかる有機化学シリーズ5 有機立体化学, 東京化学同人(2008)
(インタビュアー 藤井陽奈子)



