生物科学専攻(生物物理学系)・准教授 今元 泰

われわれの視覚は非常に弱い光から強い光まで認識できるが、そのダイナミックレンジは8桁に及ぶと考えられている。その理由のひとつは、網膜が暗いところではたらく桿体細胞と、明るいところではたらく錐体細胞の2種類の視細胞をもっているからである。桿体細胞は1個の光子でも興奮できるほど高感度であり、錐体細胞は強い光に素早く応答することができる。これらの視細胞で光センサーとしてはたらくタンパク質は、桿体細胞ではロドプシン、錐体細胞では色覚のために数種類あるが、まとめて錐体視物質とよばれる。ロドプシンと錐体視物質はいずれもレチナール(ビタミンAアルデヒド)を発色団とするタンパク質で、細胞内のG蛋白質を活性化するという点で非常によく似たタンパク質である。しかし、その光応答を生化学的に詳しく解析すると、ロドプシンには以下の特徴があることがわかってきた。①Gタンパク質の活性化効率が大きい。②Gタンパク質を活性化する状態の寿命が長い。③熱活性化頻度(光によらずに活性化する頻度)が低い。
このうち①と②は、活性化したロドプシンが少なくても十分な量のGタンパク質を活性化して細胞が興奮するために必要な性質である。一方、③は視細胞の暗ノイズを低減させ、暗所視を可能にするために必要な性質で、近年、特に注目されている。
脊椎動物の視物質を分子進化的に見ると、まず、錐体視物質が多様化して色覚が可能になり、その後にロドプシンが分化して暗所視が可能になったと推測される。分子系統樹とアミノ酸配列の保存性をよく検討すると、錐体視物質がロドプシンに進化するのに必要であったアミノ酸置換が浮かびあがってくる。これを実際に変異体解析によって確認すると、2個のアミノ酸の置換でほぼ再現できることがわかった。暗所視の獲得は、動物が夜行性に移行するために必須であったと推測されるが、そのような高次の進化もタンパク質の分子進化が基礎になっていると考えられる。
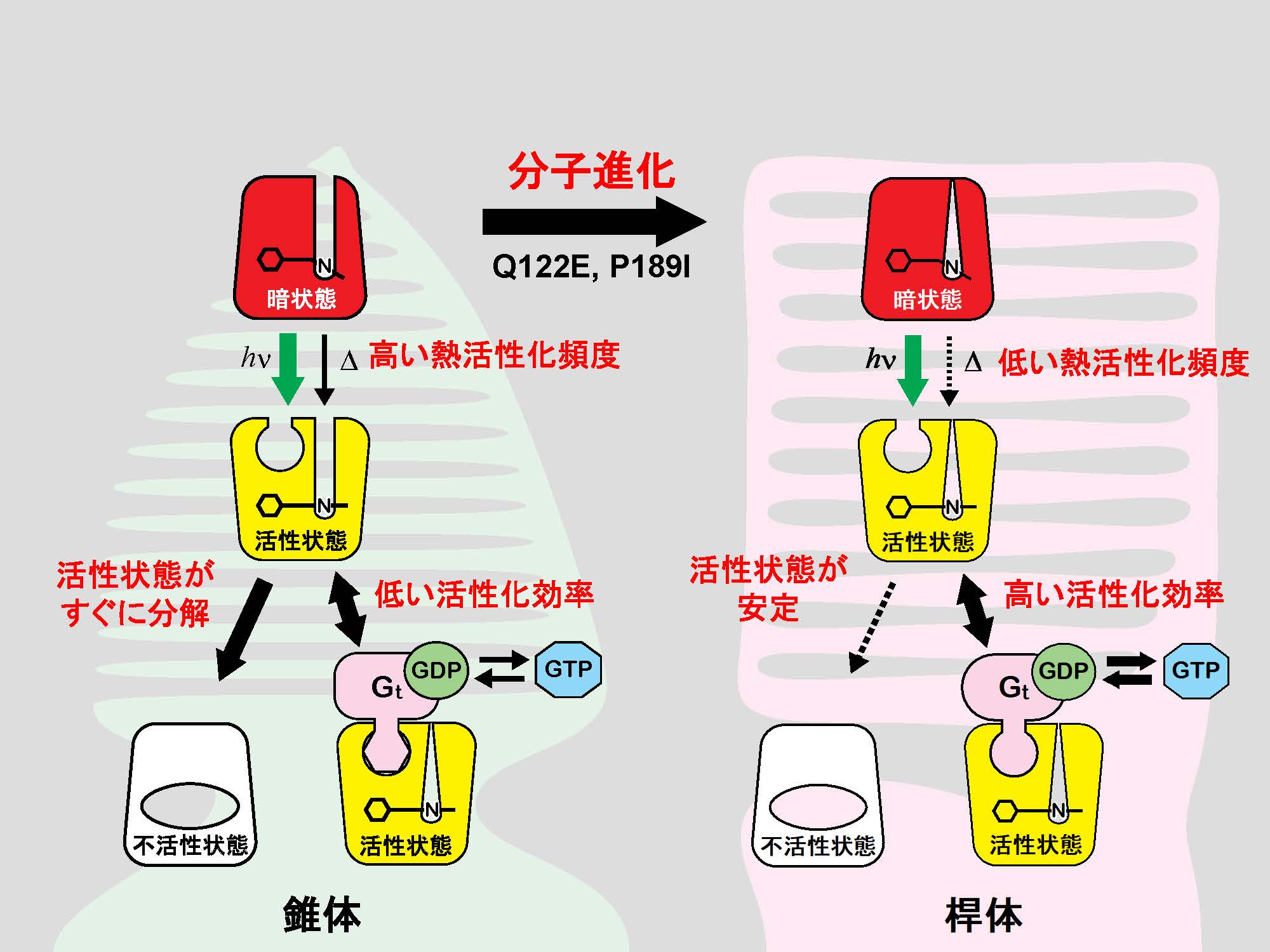
図.錐体視物質とロドプシンの光反応の比較。錐体視物質もロドプシンも、光吸収によってG蛋白質を活性化できる状態(活性状態)に変化する。ロドプシンの活性状態は、錐体視物質のものよりも効率的にGタンパク質(Gt)を活性化し、寿命も長い。また、ロドプシンも錐体視物質も熱反応によって活性化するが、ロドプシンではその頻度が極めて低い。これらの分子特性の違いは、2個のアミノ酸の置換でほぼ再現できる。


